Es resol l’estructura d’un prió infecciós
El prions, causants de malalties com el Creutzfeltd Jakob en persones o la malaltia de les vaques boges, son agents infecciosos poc convencionals. El principal motiu d’aquesta raresa és que, segons diu la teoria més acceptada a dia d’avui, no tenen material genètic!
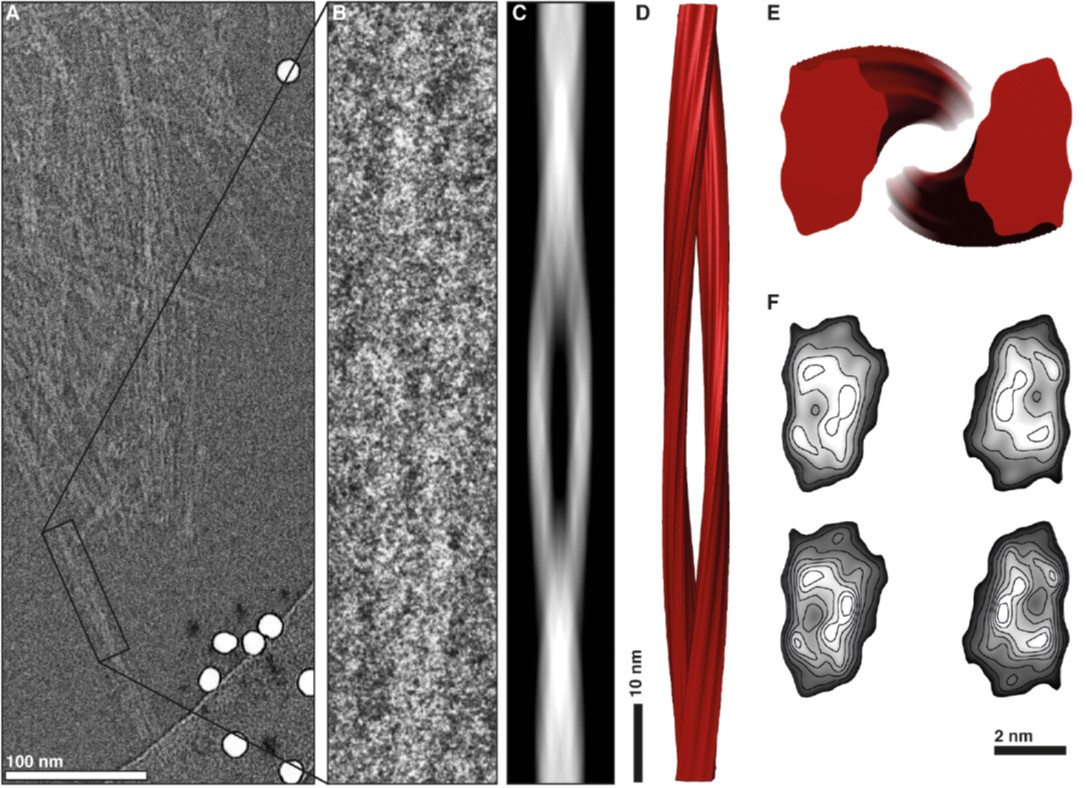
Imatge: reconstrucció 3D d’una fibril·la prionica. doi:10.1371/journal.ppat.1005835.g006
Virus, fongs, bacteris… tots aquests patògens tenen un genoma que permet estudiar-los i classificar-los, però els prions estan formats, únicament, de proteïna. Aquesta proteïna, per embolicar més la troca, la sintetitzem nosaltres mateixos, sobretot a les nostre neurones, que la tenen enganxada a la seva membrana citoplasmàtica. I el que defineix una malaltia priònica (també anomenades encefalopaties espongiformes transmissibles) és que s’acumula al cervell una forma patològica de la proteïna priònica, que provoca neurodegeneració.
Així doncs, què és el que diferencia la proteïna priònica sana que sintetitzen les nostres neurones de la proteïna priònica patològica, la que causa la malaltia?
I encara podem fer-nos una altra pregunta: On emmagatzema un prió la informació que defineix quina malaltia provocarà? Perquè… no és el mateix que una ovella s’infecti de Scrapie o que s’infecti d’Encefalopatia Espongiforme Bovina (la famosa EEB o malaltia de les vaques boges). En tots dos casos aquesta pobre ovella acumularà els seus propis prions al cervell, però la malaltia que tindrà serà diferent depenent de amb quin dels dos prions s’hagi infectat.
Sembla a ser que la clau de tot això rau en l’estructura d’aquesta proteïna. Si be la composició molecular serà sempre la mateixa (els aminoàcids que formen la proteïna, no canvien) es poden trobar diferències en l’estructura de la proteïna. Diferencies entre l’estructura dels prions sans que sintetitzen les neurones i els que provoquen la malaltia acumulant-se al cervell, però també diferencies entre l’estructura dels diferents tipus de prions patològics que trobem a la naturalesa.
Així doncs entre els científics que estudiem les malalties priòniques n’hi ha molts que es dediquen a intentar desxifrar-ne l’estructura. Però la cosa sembla que no és senzilla. Els prions patològics no posen la feina fàcil! Resulta que tendeixen a agregar-se i formen precipitats i això ha impedit en gran mesura l’estudi de la seva estructura.
The Structural Architecture of an Infectious Mammalian Prion Using Electron Cryomicroscopy Ester Vázquez-Fernández, Matthijn R. Vos, Pavel Afanasyev, Lino Cebey, Alejandro M. Sevillano, Enric Vidal, Isaac Rosa, Ludovic Renault, Adriana Ramos, Peter J. Peters, José Jesús Fernández, Marin van Heel, Howard S. Young,Jesús R. Requena, Holger Wille PLOS Pathogens 2016
En un estudi, recentment publicat a la prestigiosa revista científica PLOS Pathogens, s’ha aconseguit resoldre finalment l’estructura d’un prió infecciós. Per fer-ho ha calgut donar moltes voltes: modificar genèticament un model de ratolí per que fabriqués proteïna prió que no s’enganxés a la membrana de les neurones, infectar aquests ratolins, purificar la proteïna infecciosa del seu encèfal i finalment, mitjançant tècniques de criomicroscòpia electrònica i potents eines informàtiques, s’ha pogut definir l’estructura d’un prió infecciós.
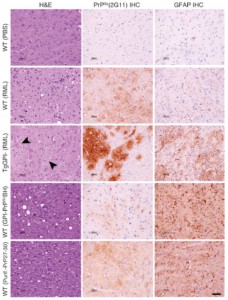
Estudi neuropatològic dels encèfals dels models de ratolí utilitzats. doi:10.1371/journal.ppat.1005835.g002
Des de l’IRTA-CReSA hem col·laborat, modestament, en aquest estudi ajudant a demostrar que efectivament el prió que s’ha pogut analitzar era infecciós. Això ho hem fet mitjançant l’estudi neuropatològic i immunohistoquímic dels cervells de ratolins inoculats amb la mateixa proteïna purificada que es va utilitzar per determinar l’estructura. Aquests experiments s’han dut a terme al laboratori PRIOCAT que es troba dins de la unitat de biocontenció de nivell 3 de l’IRTA-CReSA, que compta amb les condicions de bioseguretat necessàries per a poder treballar amb aquests agents patògens.
Les dades obtingudes contradiuen molts dels models teòrics sobre l’estructura dels prions que s’havien proposat fins ara i permetran la formulació dels mecanismes moleculars que hi ha darrera de la replicació del prions de mamífers amb malalties espongiformes transmissibles.