Avances en el desarrollo de la vacuna BA71ΔCD2 frente a la peste porcina africana, y en el conocimiento de la inmunidad asociada a la protección

La peste porcina africana (PPA) es una enfermedad vírica letal de declaración obligatoria dentro del marco de la Organización Mundial de Sanidad Animal (OMSA, antigua OIE) actualmente responsable de una pandemia con consecuencias devastadoras para la industria porcina a nivel mundial. La enfermedad está causada por el virus de la PPA (VPPA), que afecta a cerdos y jabalíes con una mortalidad cercana al 100% en sus formas agudas. Actualmente no existe una vacuna eficaz aprobada a nivel global. Por ello, el control de la enfermedad recae en la implementación de medidas de bioseguridad drásticas y de políticas de vaciado sanitario en zonas afectadas.
En el grupo liderado por el Dr. Fernando Rodríguez (IRTA-CReSA), juntamente con el Dr. Jordi Argilaguet, varios colaboradores científicos y la empresa internacional Huvepharma, hemos desarrollado un prototipo vacunal basado en una vacuna viva atenuada en la que se ha eliminado la proteína CD2v del virus virulento parental BA71 (BA71ΔCD2). Este virus recombinante se diferencia de otros generados por otros laboratorios en su capacidad de proteger los cerdos no solo frente a la infección con la cepa virulenta homóloga (BA71), sino también por conferir protección cruzada frente a la infección letal con cepas de otros genotipos, incluida la del virus virulento pandémico (Georgia2007). La primera novedad de nuestro trabajo es que se demuestra que la inoculación intranasal de BA71ΔCD2 es mucho más segura que la intramuscular (vía de administración normalmente utilizada), manteniendo su enorme eficacia, incluso frente a la infección letal por contacto con cerdos infectados con el VPPA pandémico. Hasta ahora, este tipo de vacunas vivas, basadas en virus recombinantes atenuados mediante la eliminación de genes virales e inoculados intramuscularmente, son la única estrategia de inmunización que ha demostrado una eficacia elevada. De hecho, una de estas vacunas (Navet-ASFVac) se ha licenciado recientemente para su uso en Vietnam. No obstante, el uso de esta vacuna se suspendió temporalmente debido a la aparición de brotes de PPA posiblemente asociados a defectos en los protocolos de vacunación seguidos en algunas granjas, confirmando en cualquier caso la principal limitación de esta estrategia vacunal: la bioseguridad derivada de su propia naturaleza viva. Así pues, es de vital importancia seguir investigando con el objetivo de reducir los problemas de bioseguridad asociados a las vacunas vivas atenuadas. Nuestro estudio incorpora una novedad en este sentido, demostrando que, simplemente cambiando la ruta de inoculación de intramuscular a intranasal, se mejora exponencialmente la seguridad de la vacuna, al menos para el caso de BA71ΔCD2. En paralelo a este tipo de vacunas, que sin duda podrán ayudar a controlar la enfermedad en zonas afectadas o de riesgo en el corto-medio plazo, seguimos avanzando en las vacunas del futuro, basadas en subunidades, mucho más seguras, pero que necesitan de mucha más inversión en I+D+i tanto en la caracterización de antígenos virales inmunogénicos, como en el conocimiento de los mecanismos inmunológicos asociados a la protección frente al VPPA.
El segundo objetivo del estudio fue caracterizar los mecanismos inmunológicos celulares asociados con la protección inducida mediante la vacunación intranasal con el BA71ΔCD2. Hasta el momento varios estudios habían demostrado que células CD8+ juegan un papel en protección. No obstante, todavía se desconocían los principales componentes inmunológicos y los mecanismos funcionales asociados a esta protección. Gracias a la estrecha colaboración con el grupo bioinformático de la Dr. Anna Esteve-Codina (CRG-CNAG), en este estudio hemos realizado estudios de transcriptómica tanto a nivel poblacional (con células de sangre) como de células individuales (con células de linfonodo submandibular) que han permitido caracterizar la respuesta inmune inducida por la vacuna. Para ello, células de cerdos vacunados o no vacunados fueron estimuladas in vitro con el VPPA, para poder caracterizar la respuesta específica de vacuna que se induce en un segundo encuentro con el virus. Los resultados demostraron que la vacuna induce dos tipos celulares que se activan tras la estimulación específica con el virus: por un lado, células de memoria polifuncionales de tipo Th1 (CD4+CD8+) que producen las citoquinas IFNG y TNF; y, por otro lado, células citotóxicas con capacidad de eliminar células infectadas. Finalmente, también observamos que, juntamente con esta respuesta inmune adaptativa de memoria, se activa una respuesta inflamatoria mediada por macrófagos. Además, pudimos demostrar que la activación de macrófagos es dependiente de la señalización mediada por IFNG, indicando que la respuesta inflamatoria observada depende de la activación previa de las células Th1 inducidas por la vacuna que secretan IFNG. A pesar de que el rol relativo en protección de cada uno de estos componentes inmunológicos todavía no se ha evaluado, estos resultados significan un avance importante en el conocimiento de la inmunidad frente a la PPA.
En conjunto, este estudio representa un avance en dos aspectos importantes en la investigación de la PPA. Por un lado, se demuestra que la vacunación intranasal con el virus vivo atenuado BA71ΔCD2 es segura, inmunogénica, y eficaz frente a un desafío letal similar al que ocurre en granjas afectadas. Mientras estudios de eficacia y seguridad necesarios para su registro están en marcha, cabe recordar que es la única vacuna experimental que ha demostrado eficacia frente a los dos genotipos circulantes actualmente en Asia y Europa. Por otro lado, la detallada caracterización de la respuesta inmune asociada con la protección abre la puerta a nuevos estudios enfocados a identificar los componentes inmunológicos que correlacionan con protección, un tema crucial pendiente de resolver. Este conocimiento no solo permitiría evaluar candidatos vacunales sin necesidad de infectar los animales, sino que es de gran importancia para el desarrollo racional de las vacunas del futuro.
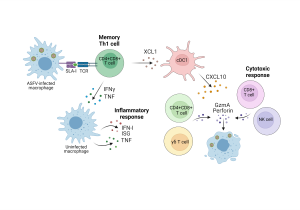
Graphic Abstract – Cross-protection against African swine fever virus upon intranasal vaccination is associated with an adaptive-innate immune crosstalk
Cross-protection against African swine fever virus upon intranasal vaccination is associated with an adaptive-innate immune crosstalk
Laia Bosch-Camós, Uxía Alonso, Anna Esteve-Codina, Chia-Yu Chang, Beatriz Martín-Mur,Francesc Accensi, Marta Muñoz,María J. Navas, Marc Dabad, Enric Vidal, Sonia Pina-Pedrero, Patricia Pleguezuelos, Ginevra Caratù, María L. Salas, Lihong Liu, Stanimira Bataklieva, Boris Gavrilov, Fernando Rodríguez, Jordi Argilaguet
Published: November 9, 2022
https://doi.org/10.1371/journal.ppat.1010931
Autores de la entrada: Uxía Alonso, Laia Bosch, Fernando Rodríguez i Jordi Argilaguet













