Comentarios virus-lentos (32): H5N8 ya está aquí… ¿podremos prevenir la próxima?

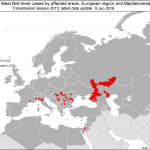
En la última entrada, hace unos pocos días, comentábamos que H5N8 había llegado al otro lado de los Pirineos y que no tardaría en saltar hacia la Península. Hace unos días se informaba de la detección de la cepa H5N8 en dos gansos comunes (Anser anser) encontrados muertos en la laguna de La Nava de Fuentes, en Palencia (Castilla y León). Esta detección fue posible por lo que llamamos vigilancia epidemiológica pasiva.
Imagen de portada: Oca vulgar (Anser anser) por Michael Maggs
¿Vigilancia epidemiológica pasiva? ¿Vigilancia epidemiológica de aves silvestres? Expliquemos un poco más esto.
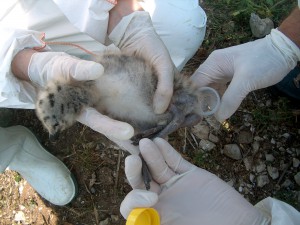
Los programas de vigilancia pasiva de la gripe aviar en aves silvestres se basan en la detección y análisis de cualquier incremento anormal en la mortalidad de aves silvestres que pueda relacionarse con la aparición de influenza aviar. En resumen, aves silvestres muertas que no lo hayan sido por acción de un depredador. En estos casos se procederá a la recogida y envío de las muestras de cadáveres de aves silvestres a los laboratorios de referencia para su análisis. Nuestro centro de investigación, IRTA-CReSA es el responsable de la vigilancia en Cataluña, por delegación del Departament de Agricultura, Ramaderia, Pesca i Alimentació (DARP) de la Generalitat da Catalunya. La recogida de las aves debe hacerse por personal especializado o bien adoptando unas precauciones mínimas de seguridad (guantes, pinzas, mascarilla filtrante si se dispone de ella). Un punto clave de la vigilancia pasiva es proporcionar a la población las pautas de actuación si encuentran aves muertas. Como se trata de aves muertas estamos ante un proceso agudo, y fatal, y las muestras que se analizan habitualmente son hisopos traqueales y cloacales (que son las vías habituales de excreción viral). La detección de genoma del virus implica positividad, e infección reciente.
En contraposición a los programas de vigilancia pasiva están los programas de vigilancia activa; en estos casos se establece un muestreo en aves silvestres en diferentes épocas del año, para intentar comprender mejor la epidemiología del virus. El muestreo se intensifica en las épocas de cría, paso migratorio e invernada. Este muestreo se puede hacer mediante capturas o muestreando aves muertas por cazadores. El número de aves, su distribución durante el año y las especies implicadas, debe ser cuidadosamente calculado para maximizar la capacidad de detección. En estos casos las muestras de referencia son las mismas; hisopos traqueales y cloacales pero también puede extraérseles suero (de las aves vivas) para controlar exposición previa al virus de la gripe aviar, y respecto a qué cepa en concreto.
El foco de atención de los dos programas están en las variantes H5 ó H7 de los virus de la gripe aviar que son donde se encuentran las variantes altamente patogénicas para las aves… y en algunas cepas, para humanos.
Esto que acabamos de comentar tiene la función de un radar, que nos informa de la posible circulación del virus en las poblaciones silvestres y de una potencial afectación a las poblaciones avícolas de producción. Por lo tanto, es una medida preventiva, que se complementa con planes de vigilancia equivalentes en las explotaciones avícolas. En estos casos, muchos más controlables y cuantificables, los propietarios o el personal que se ocupa de los animales deberán notificar con urgencia en caso de detectar alguno, o más de uno, de los siguientes signos (todos ellos medidas indirectas de un proceso infeccioso):
- Caída del consumo de pienso o agua superior a un 20%,
- Caída en la puesta superior a un 5% durante dos días consecutivos,
- Mortalidad superior al 3% durante una semana,
- Cualquier signo clínico o post-mortem que sugiera la presencia de la enfermedad.
Pero los planes de vigilancia no son la solución única para prevenir la gripe aviar; hay tres tipos de medidas a utilizar conjuntamente.
En primer lugar, las medidas de bioseguridad y vigilancia entre las que incluiríamos:
- poner en cuarentena las granjas infectadas;
- restricciones a la circulación, movimiento de aves de corral en las zonas circundantes a la zona afectada, ya esté confirmada o aún con status de sospechosa;
- estrictas medidas de higiene como el uso de ropa de protección y desinfección de los vehículos que pasan por zonas infectadas para prevenir la propagación del virus a través de fomites o equipos contaminados;
- la vigilancia de las aves silvestres y de corral en las áreas circundantes a la zona afectada, ya confirmada o aún sólo sospechosa.
En segundo lugar, si se detecta un brote, sacrificio de las aves infectadas. Actualmente no existe una cura para la gripe aviar altamente patógena y se adopta una versión plumífera de «muerto el perro, muerto la rabia«. En esta situación, para prevenir la propagación del virus, entrarían las siguientes acciones;
- Todas las aves en un lugar determinado (por ejemplo, una granja) donde hay casos positivos deben ser eliminadas… aunque no se hayan muestreado todas ellas.
- Los cadáveres de las aves sacrificadas deben ser debidamente eliminados, lo que se hace generalmente mediante su entierro o su incineración.
- Las aves de explotaciones en los alrededores de la zona específica afectada pueden ser también reglamentariamente sacrificadas. El radio afectado puede ser de varios kilómetros.
En tercer lugar, para evitar una mayor propagación de la infección, se puede implementar un programa de vacunación si la vacuna está cuantitativamente disponible teniendo en cuenta lo siguiente:
- La vacunación es una estrategia de prevención,
- La vacunación no siempre previene de la infección, pero el ave vacunada no mostrará sintomatología evidente ni se morirá como si harán las aves infectadas no vacunadas.
- Si un ave vacunada se infecta, o bien no excretará virus o lo hará a niveles, cantidades mucho más bajas que un ave infectada no vacunada y esto ayuda a detener la circulación del virus.
La presencia de virus de la gripe aviaria de alta patogenicidad (Highly pathogenic Avian Influenza, HPAI en inglés) en España no es muy frecuente.
En silvestres, el único caso de HPAI H5N1 fue en julio de 2006, aislado de un ejemplar silvestre encontrado muerto, un somormujo lavanco (Podiceps cristatus).

Somormujo lavanco (Podiceps cistatus). Imagen: Mark Medcalf.
En cuanto a aves de producción se dio un foco de HPAI H7N7 en una explotación de gallinas de puesta en Guadalajara (Castilla-La Mancha), a finales de 2009. En 2013 se detectó un foco de influenza aviar H7 (que tiene cepas altamente patogénicas para aves). En este caso, pero fue un virus aviar de baja patogenicidad (H7N1) en una explotación de gallinas reproductoras en Lleida. En ambos focos, después de la confirmación, se delimitó una zona de protección y una zona de vigilancia para prevenir la difusión de la enfermedad, así como el sacrificio de todas las aves presentes en la explotación (más de 300.000 gallinas en Guadalajara; 13.000 en Segrià), la destrucción de todos los materiales presentes en la explotación que pudieran vehicular el virus (por ejemplo todos los huevos y el pienso) y su posterior limpieza y desinfección. No se detectaron focos secundarios en ninguno de los dos casos.
Sin embargo, todas las detecciones de gripe aviar son importantes, tanto las cepas HPAI como LPAI… a modo de ejemplos, durante 1983 y 1984 se produjo un brote epizoótico en Estados Unidos originado por el subtipo H5N2 que comenzó con bajas tasas de mortalidad, para ir evolucionando y al cabo de seis meses alcanzar tasas de mortalidad en aves del 90%. Al final hubo que sacrificar más de 17 millones de aves. O un brote de gripe aviaria LPAI H5N2 que comenzó en México en 1992 y que terminó siendo altamente mortal y no pudo ser controlado hasta 1995.
Y es que cuesta mucho controlar las aves, sobre todo las silvestres, y más aún limpiar y sanear una explotación porque los virus influenza pueden subsistir, mantenerse potencialmente infecciosos sobre superficies, herramientas y materiales, las fomites. No demasiado tiempo, pero pueden.
Pero esta, esta es otra historia.
Agradecimientos: El autor agradece a la Dra. Natàlia Majó (IRTA-CReSA, UAB) la revisión de la entrada.













És una pena que la vigilància activa en aus salvatges es vagi aturar fa uns anys ja, penso que aportava informació valuosa dels virus d’influença circulants…