Se resuelve la estructura de un prión infeccioso
Los priones, causantes de enfermedades como el Creutzfeltd Jakob en personas o la enfermedad de las vacas locas, son agentes infecciosos poco convencionales. El principal motivo de esta rareza es que, según dice la teoría más aceptada a día de hoy, no tienen material genético!
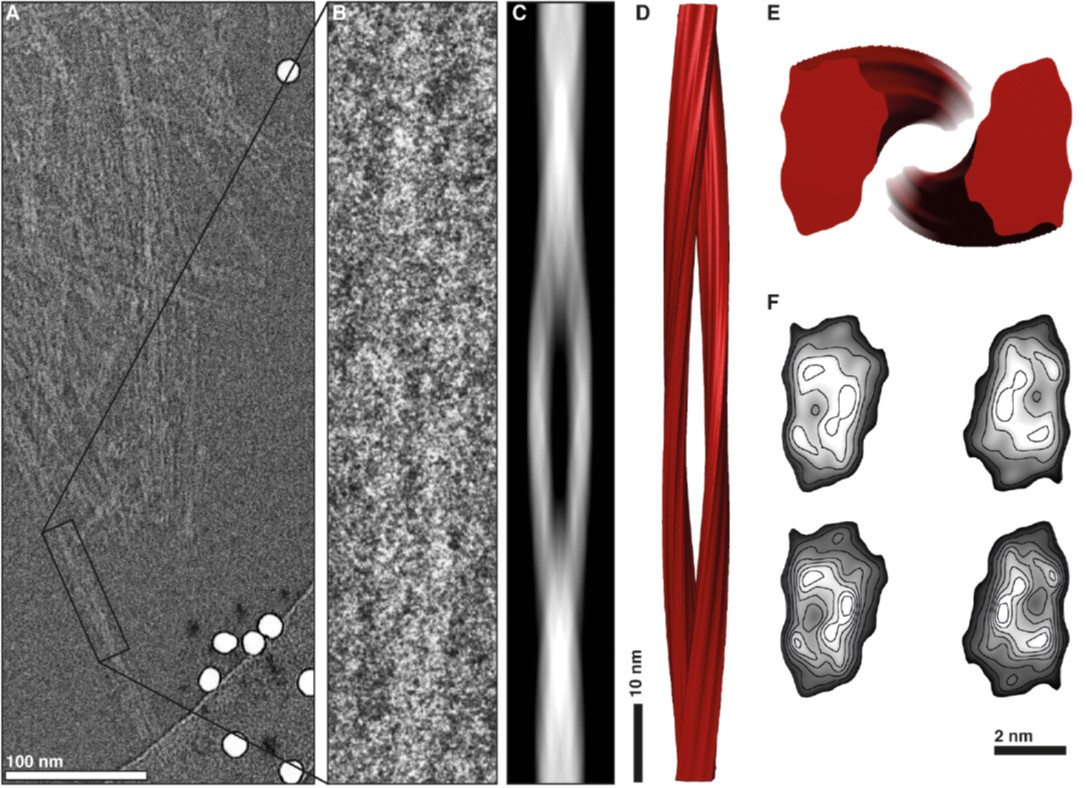
Imagen: reconstrucción 3D de una fibrilla priónica. doi:10.1371/journal.ppat.1005835.g006
Virus, hongos, bacterias… todos estos patógenos tienen un genoma que permite estudiarlos y clasificarlos, pero los priones están formados únicamente de proteína. Esta proteína, para rizar más el rizo, la sintetizamos nosotros mismos, sobre todo en nuestras neuronas, que la tienen pegada en su membrana citoplasmática. Y lo que define una enfermedad priónica (también conocidas como encefalopatías espongiformes transmisibles) es que se acumula en el cerebro una forma patológica de la proteína priónica, que provoca neurodegeneración.
Así pues, ¿qué es lo que diferencia la proteína priónica sana que sintetizan nuestras neuronas de la proteína priónica patológica, la que causa la enfermedad?
Y aún podemos hacernos otra pregunta: ¿Dónde almacena un prión la información que define qué enfermedad provocará? Porque… no es lo mismo que una oveja se infecte de Scrapie o que se infecte de Encefalopatía Espongiforme Bovina (la famosa EEB o enfermedad de las vacas locas). En ambos casos esta pobre oveja acumulará sus propios priones en el cerebro, pero la enfermedad que tendrá será diferente dependiendo de con cuál de los dos priones se haya infectado.
Parece ser que la clave de todo esto radica en la estructura de esta proteína. Si bien la composición molecular será siempre la misma (los aminoácidos que forman la proteína, no cambian) se pueden encontrar diferencias en la estructura de la proteína. Diferencias entre la estructura de los priones sanos que sintetizan las neuronas y los que provocan la enfermedad acumulándose en el cerebro, pero también diferencias entre la estructura de los diferentes tipos de priones patológicos que encontramos en la naturaleza.
Así pues entre los científicos que estudiamos las enfermedades priónicas hay muchos que se dedican a intentar descifrar su estructura. Pero la cosa parece que no es sencilla. Los priones patológicos no ponen el trabajo fácil! Resulta que tienden a agregarse y forman precipitados y esto ha impedido en gran medida el estudio de su estructura.
The Structural Architecture of an Infectious Mammalian Prion Using Electron Cryomicroscopy Ester Vázquez-Fernández, Matthijn R. Vos, Pavel Afanasyev, Lino Cebey, Alejandro M. Sevillano, Enric Vidal, Isaac Rosa, Ludovic Renault, Adriana Ramos, Peter J. Peters, José Jesús Fernández, Marin van Heel, Howard S. Young,Jesús R. Requena, Holger Wille PLOS Pathogens 2016
En un estudio, recientemente publicado en la prestigiosa revista científica PLOS Pathogens, se ha conseguido resolver finalmente la estructura de un prión infeccioso. Para ello ha sido necesario dar muchas vueltas: modificar genéticamente un modelo de ratón para que fabricara proteína prión que no se pegara a la membrana de las neuronas, infectar estos ratones, purificar la proteína infecciosa de su encéfalo y finalmente, mediante técnicas de criomicroscopía electrónica y potentes herramientas informáticas, finalmente se ha podido definir la estructura de un prión infeccioso.
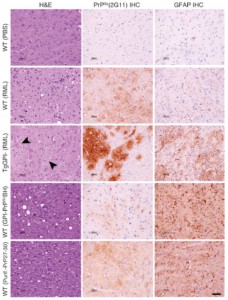
Estudio neuropatológico de los encéfalos de los modelos de ratón utilizados. doi:10.1371/journal.ppat.1005835.g002
Desde el IRTA-CReSA hemos colaborado, modestamente, en este estudio ayudando a demostrar que efectivamente el prión que se ha podido analizar era infeccioso. Esto lo hemos hecho mediante el estudio neuropatológico e inmunohistoquímico de los cerebros de ratones inoculados con la misma proteína purificada que se utilizó para determinar la estructura. Estos experimentos se han llevado a cabo en el laboratorio PRIOCAT que se encuentra dentro de la unidad de biocontención de nivel 3 del IRTA-CReSA, que cuenta con las condiciones de bioseguridad necesarias para poder trabajar con estos agentes patógenos.
Los datos obtenidos contradicen muchos de los modelos teóricos sobre la estructura de los priones que se habían propuesto hasta la fecha y permitirán la formulación de los mecanismos moleculares que hay detrás de la replicación del priones de mamíferos con encefalopatías espongiformes transmisibles.